Способы регистрации и оценки такого рода упорядоченности в организации генетического материала, с нашей точки зрения, могли бы представлять фундаментальный интерес, проливая свет на характер упаковки хроматина.
С этой целью усилиями лабораторий клеточной биологии и биофизики макромолекул ОМРБ на установках малоуглового рассеяния "Мембрана" в ПИЯФ и YuMO в ОИЯИ была предпринята попытка исследовать структуру ядер эритроцитов курицы. Полученные предварительные результаты (рис. 3) позволяют сделать предположение о существовании в ядрах неких фрактальных структур, размер минимального элемента которых сопоставим с нуклеосомным размером. Обнаружение такого рода организации генетического материала в клетках могло бы представлять не только фундаментальный интерес, но иметь и прикладное значение, связанное с изменениями организации генетического материала при различных функциональных и патологических состояниях клеток.
Дальнйшие исследования различных препаратов ядер клеток высших эукариот, включая человека, требуют применения высокопоточного реактора, установок малоуглового рассеяния нейтронов с более высоким разрешением, а также методов рассеяния нейтронов позволяющих исследовать динамические аспекты структуры ядер (нейтронное спин-эхо, времяпролетная спектроскопия). Такой комплексный подход может позволить получить информацию об организации генетического материала клеток высших. Лаборатория клеточной биологии ОМРБ обладает опытом приготовления препаратов различного рода ядер клеток высших эукариот [2,3], в том числе лишенных большей части белков.
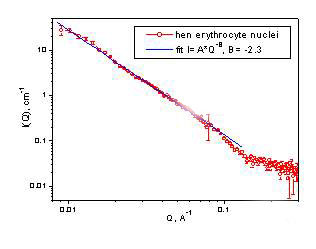
рис.3
Гликопротеины - это гликоконьюгаты, которые представляют собой полипептидную цепь, к которой, путем гликозилирования, ковалентно присоединены углеводные цепи, гликаны. Гликозилирование есть разновидность посттрансляционной модификации белков, чрезвычайно широко распространено и встречается практически во всех эукариотических организмах, от дрожжей до человека. Углеводные структуры гликопротеинов весьма разнообразны как по моносахаридным остаткам, так и по конфигурациям связей и по размерам углеводных цепей, что делает гликозилирование одним из самых тонких механизмов посттрансляционного процессинга.
Принято выделять внутримолекулярную роль гликозилирования - в этом случае модификация полипептидной цепи гликанами вызывает определенное изменение вторичной и третичной структуры белка, что, в свою очередь, изменяет его физико-химические и ферментативные свойства. Внутримолекулярная роль гликозилирования является конкретной по отношению к каждому отдельному белку или ферменту. При внемолекулярной роли гликозилирования углеводная составляющая гликопротеина не оказывает существенного влияния на его физико-химические свойства, а является некоторым определенным молекулярным сигналом, обеспечивающим корректное функционирование полиферментных систем и организма в целом. Интенсивное изучение феномена гликозилирования связано, прежде всего, с ключевой ролью, которую играет такая модификация белка при осуществлении различных биологических функций. Такие ключевые процессы, как пролифирация, адгезия, дифферинцировка связаны именно с постадийным изменением углеводной компоненты ряда гликопротеинов, регулирующих клеточный цикл. На сегодняшний день является полностью доказанным, что аномальное изменение углеводных компонент гликопротеинов сопровождает ряд заболеваний и, прежде всего, онкологические патологии.
Проблема повышения стабильности и функциональной активности ферментов путем получения их новых гликоформ является важной проблемой для биотехнологии и фармокопии и успешно решается сегодня. Таким образом, структурно-функциональное изучение гликопротеинов является на сегодня одной из наиболее актуальных задач физико-химической биологии.
В качестве примера использования малоуглового рассеяния нейтронов для выяснения особенностей структуры субъединичных гликопротеинов мы приведем белок биотехнологического значения арабитол фосфат дегидрогиназу. Этот белок относительно небольшого молекулярного веса (Mr~41 kDa) в нативной форме существует как тетрамер. Фермент для своего функционирования требует присутствия двухвалентных ионов и может быть ингибирован добавлением в раствор EDTA. Для проверки гипотезы о том, что присутствие EDTA приводит к диссоциации тетрамера на мономеры были зарегистрированы спектры малоуглового рассеяния нейтронов для арабитол фосфат дегидрогиназы в нативной форме и в присутствии EDTA на установках "Мембрана" в ПИЯФ и YuMO в ОИЯИ.
Из приведенных на рис.4 кривых видно, что удаление двухвалентных ионов не приводит к каким-либо существенным структурным изменениям, хотя активность фермента при этом подавлена почти полностью.
Приведенные примеры использования рассеяния нейтронов в научных исследованиях ОМРБ касаются только структурных аспектов описанных объектов. Но эти исследования являются необходимыми для перехода к изучению динамических аспектов указанных молекулярно-биологических систем. Следует также отметить, что представленными здесь проблемами не ограничивается спектр научных направлений ОМРБ, в которых возможно получение важной структурно-динамической информации с применением методов нейтронной физики, поэтому круг задач, решаемых методами рассеяния нейтронов, будет в дальнейшем расширяться.
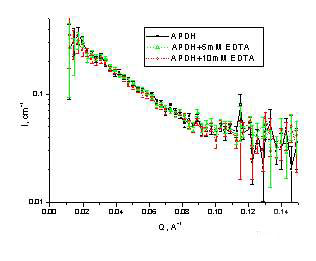
рис.4
В заключение следует отметить, что молекулярная биология с ее фундаментальными и прикладными проблемами, биотехнология и фармакопия в высшей степени заинтересованы в действующем высокопоточном реакторе ПИК, имеющем парк современных установок упругого, квазиупругого и неупругого рассеяния нейтронов, позволяющих на высоком уровне получать структурную и динамическую информацию об изучаемых биологических системах в нативных условиях.
Литература
[1] E.A.Namsaraev,
D. Baitin, I.V.Bakhlanova, A.A.Alexseyev, H.Ogawa, and V.A.Lanzov, Biochemical
basis of hyper-recombinogenic activity of Pseudomonas aeruginosa RecA protein
in Escherichia coli cells Mol Microbiol, 27 (1998) 727.
[2] M.Filatov, E.Varfolomeeva, D.Varfolomeev, Method of incorporation cells
into polyacrilamide spheries Cytometry, s.7 (1994)26.
[3]
M.Filatov, E.Varfolomeeva, Flow cytometric characterization of chromatin dinamic
organization Cytometry, s.7 (1994) 30.