В работе [1], выполненной в ОМРБ в лаборатории молекулярной генетики, было показано, что замена в клетках Escherichia coli (E.coli) гена recA на ген recA из Pseudomonas. aeruginosa (P.aeruginosa) приводит к гиперрекомбинационной активности (высокая частота рекомбина-ционных обменов на единицу длины ДНК) клеток E. coli при отсутствии конститутивного SOS-ответа.
В 2001 году в
ОМРБ силами лабораторий биофизики макромолекул и молекулярной генетики на установке
малоуглового рассеяния нейтронов YuMO в Дубне были начаты работы по сравнительному
изучению спиральной структуры нуклеопротеидного филамента (пресинаптического комплекса)
белков RecAEc из
На рис.2
в качестве примера приведены две кривые малоуглового рассеяния нейтронов на белке
RecAEc из
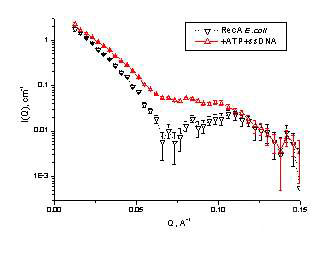
Рис.2
Полученные предварительные результаты характеризуют структурный аспект взаимодействия белка RecA с нуклеотидными кофакторами и онДНК. Динамические данные о взаимодействия белка RecA с нуклеотидными кофакторами и онДНК просто отсутствуют. Для получения этих данных методами нейтронной физики необходимо наличие высокопоточного реактора типа реактора ПИК и спектр установок, включающий кроме установки малоуглового рассеяния нейтронов, такие как нейтронное спин-эхо и время- пролетная спектроскопия. Эти установки должны позволять работать с биологическими объектами. При этом возможности ОМРБ в получении белков RecA как из других организмов, так и методами генной инженерии, мутантных по тем или иным признакам, позволили бы связать структурные и динамические изменения с изменениями функции белка RecA и тем самым продвинуться в понимании механизмов гомологичной рекомбинации.
Ядра клеток эукариот, находясь в интерфазном состоянии, содержат ДНК в высокоорганизованном и плотно упакованном состоянии. Упаковка эта осуществляется белками, среди которых ключевую роль играют гистоны. В результате образуется комплексная структура, которая называется хроматин.
Основной элементарной единицей хроматина является фрагмент ДНК длиной 146 пар оснований, закрученных вокруг 8 молекул гистоновых белков - кора. Кор состоит из 4-х типов коровых гистонов H2A, H2B, H3, H4 по 2 молекулы каждого.
Такого рода повторяющиеся элементы хро-матина, называются нуклеосомами, имеют характерный размер порядка 10 нм и разделены участками ДНК различной длины - линкерами. С линкерными областями связан линкерный гистон Н1, который способствует дальнейшей компактизации хроматина. Нуклеосомы уложены спирально, в результате чего образуются часто наблюдаемые на электронномикроскопических фотографиях нити толщиной 30 нм. При диссоциации хроматина обнаруживается, что эти 30 нм нити образуют петли гистонов H2A, H2B, H3, H4 по 2 молекулы различной длины, прикрепленные к неким матриксным белковым структурам. Размер этих петель варьирует от 10 тыс. до нескольких сотен тысяч пар оснований и различается в клетках разных типов. Реальная укладка этих петель в ядрах клеток, как внутри отдельных петель, так и разных петель в отношении друг к другу остается неизвестной.
Между тем можно предположить, что на этом уровне организации, во-первых, неизбежно должна существовать некоторая степень упорядоченности взаиморасположения (дальний порядок) низших элементов организации хроматина, а, во-вторых, степень этой упорядоченности может варьировать в ядрах разных клеток в зависимости от их размеров и биологической активности.
Среди факторов, обуславливающих наличие дальнего порядка в ядрах нужно отметить, с одной стороны, наличие однотипных элементов хроматина, упомянутых выше, а с другой, - их крайне высокую концентрацию в ядрах. В зависимости от размера ядра концентрация ДНК в нем от 10 до 10000 раз превосходит предел растворимости высокомолекулярной ДНК.
В этой ситуации неизбежно становится существенной оптимальная укладка элементов генетического материала, особенно в ядрах малого размера.